Самоорганизующиеся нанококоны моделируют вирусы
Разработаны короткие пептидные цепочки, которые могут вступать в самоорганизацию с ДНК, образуя вирусоподобные капсулы. Такие нанококоны могут оказаться полезными для адресного переноса генов или низкомолекулярных лекарственных препаратов по организму человека.
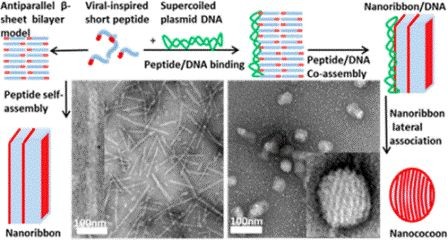
Рисунок из J. Am. Chem.
Soc. 2014, DOI: 10.1021/ja507833x
Разрабатывая новые частицы, Йин Чо (Ying Chau) и Рон НИ (Rong Ni) из Университета Науки и Технологии Гонконга, пытались смоделировать процесс того, каким образом белки вируса инкапсулируют ДНК.
Для построения модели Чо и Ни получили пептид, состоящий из шестнадцати остатков аминокислот. В процессе дизайна исследователи добились того, чтобы пептид проявлял три свойства, наиболее важных для белков вируса – способность растворяться в воде, способность связываться с ДНК и с собой.
Всего этого удалось добиться, внедрив в область пептида с одной его стороны известный фрагмент, отвечающий за связывание с ДНК, а с другой – последовательность, отвечающую за его растворимость в воде. В качестве центрального фрагмента синтетического пептида выступают короткие гидрофобные ?-складчатые белки, являющиеся производными ?-амилоидных бляшек, белков, связанных с болезнью Альцгеймера.
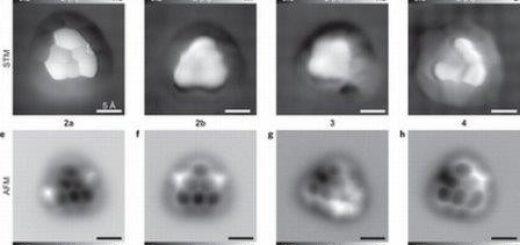
При инкубации с ДНК полученные пептиды самоорганизовывались по всей длине ДНК, образуя лентообразные надструктуры. Эти ленты связываются друг с другом, формируя эллипсоидные капсулы с длиной 12 и 65 нанометров, структура этих капсул похожа на структуру парапоксвирусов.
Складки белков, принимающие ?-складчатую вторичную структуру, которые формируют нанококоны, расположены в регулярной последовательности на расстоянии 4 нм друг от друга.
Как отмечает Джаякумар Раджадас (Jayakumar Rajadas) из Стэнфорда, исследователи из Гонконга подсмотрели идею у природы и смогли получить новые инновационные частицы для адресной доставки низкомолекулярных препаратов и генов. Он добавляет, что описанная Чо и Ни самоорганизация является очень красивым и вместе с тем удивительным результатом.
Дело в том, что вовлечение в контакт двух молекул – белка и ДНК может оказаться сложным, так как энтропийные факторы способствуют разделению этих систем. Он подчеркивает, что хотя ранее были смоделированы и получены более сложные пептидные структуры, способные к организации с ДНК, для изготовления нанококонов химики из Гонконга разработали и синтезировали гораздо более простые олигомеры аминокислот.
Тем не менее, по словам Раджадаса, те же факторы, которые обуславливают эффективность самоорганизации пептидов, могут оказаться проблемой для применения в клетках человека. Так, ?-пептиды, образуют довольно прочные кластеры, и, вполне возможно, такие прочные нанококоны будет невозможно раскрыть внутри клеток, чтобы они смогли высвободить свое содержимое.
Устойчивость нанококонов к ферментативному расщеплению может привести к тому, что они будут накапливаться в организме, образуя токсические бляшки, влияющие на обмен других белков, липидов и нуклеиновых кислот; возможно, что белковые нанококоны могут вызвать аллергическую реакцию.
Однако, несмотря на все возможные потенциальные сложности с практическим применением новых типов нанопереносчиков, Раджадас полагает, что дальнейшие работы над новой системой позволят исключить возможные риски.
Статья опубликована в JACS
Источник: chemport.ru