Расшифрована структура самого известного оптогенетического инструмента – белка канального родопсина
Ученые из Московского физико-технического института, исследовательского центра Юлиха (Forschungszentrum Julich), Европейской установки сихротронного излучения (ESRF), Института структурной биологии в Гренобле и Института биофизики Общества Макса Планка определили трехмерную структуру канального родопсина ChR2 – мембранного белка, который широко используется в оптогенетике для управления нервными клетками при помощи света. Статья опубликована в престижном журнале Science, там же вышел отзыв о ее значимости одного из ведущих ученых в этой области, кратко о работе рассказывает пресс-релиз МФТИ.
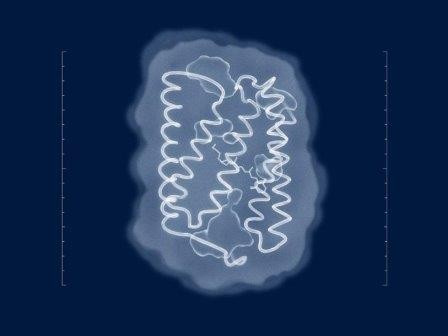
Мембранный белок канальный родопсин ChR2
© @Lion_on_helium/МФТИ
«Получением структуры, безусловно, занималось много разных групп по всему миру с самого открытия ChR2 в 2003 году, однако без особых успехов — до сих пор структуры белка в его естественном виде известно не было. Наличие структуры позволит оптогенетике делать осмысленные мутации в белке, подстраивая его под конкретные эксперименты.
Конечно, раньше это было невозможно и большинство мутаций делались трудоемким перебором или на основании структур родственных белков», — комментирует открытие Валентин Борщевский, заместитель заведующего лабораторией перспективных исследований мембранных белков МФТИ и первый автор статьи.
Оптогенетика – современная методика, которая позволяет при помощи света управлять нервными или мышечными клетками в живом организме. Кроме того, схожие методы используются для того, чтобы частично восстанавливать потерянное зрение и слух, управлять сокращением мышц.
Методы оптогенетики так же используются для того, чтобы изучать свойства естественных нейронных сетей, которые отвечают за эмоции, принятие решений и другие сложные процессы в живых организмах. В 2010 году оптогенетика была отмечена методом года редакцией престижного научного журнала Nature и прорывом десятилетия журналом Science в том же году.
Наиболее распространенный инструмент оптогенетики — светочувствительный белок ChR2, выделенный в начале XXI века из зеленых водорослей Chlamydomonas reinhardtii. Ученые встраивают этот белок в мембраны живых клеток.
Под действием света он открывается, пропуская через клеточную мембрану внутрь клетки положительные ионы. В случае нервной клетки это запускает деполяризацию мембраны, имитируя прохождение по ней нервного сигнала и активируя конкретный нейрон.
На данный момент канальный родопсин ChR2 — наиболее распространенный инструмент для активации нервных клеток, который используется повсеместно, в основном благодаря своей высокой скорости работы и относительной безвредности для клеток. Существует множество искусственных мутаций ChR2, которые модифицируют его свойства — например, увеличивают величину генерируемого тока или длину волны света, на который он «откликается».
Такой спектр модификаций позволяет подбирать белок под конкретный эксперимент на живых клетках, варьируя скорость его работы или используя различные модификации, которые откликаются на разную длину волны и могут работать независимо друг от друга.
Большинство мутаций, однако, сделаны сравнительно вслепую, методом направленной эволюции или исходя из данных по структурам похожих белков. Самая похожая структура, имеющаяся на данный момент — химера C1C2, в структуре которой примерно 70% от родственного белка ChR1 и 30% от ChR2.
Эта структура, однако, не позволяет полностью объяснить все свойства белка, а значит, и интересные для оптогенетики мутации, спрогнозированные по этой структуре, не несут особенной правдоподобности.
Чтобы изучить структуру белка, ученые использовали метод рентгеновской кристаллографии. Для его использования необходимо получить кристалл, в узлах которого сидят молекулы белка.
Это было сделано при помощи кристаллизации in meso — метода получения кристаллов мембранных белков, при котором для роста кристаллов используется особая среда, позволяющая белкам свободно перемещаться в пространстве, не выходя при этом из мембраны — липидная кубическая фаза. После этого кристаллы облучают рентгеновским излучением с длиной волны порядка 1 ангстрема (чуть меньше длины межатомной связи в белке) и снимаются данные рентгеновской дифракции, из которых затем восстанавливается структура белка.















